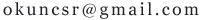(1)19g
过程:MgCl2+2NaOH=Mg(OH)2+2NaCl
溶质为NaCl,它的质量分数为10%,所以NaCl的质量为234g*10%=23.4g
根据方程式,得m(MgCl2)=(23.4/58.5)/(2/95)=19g
(2)7.1%
过程:由(1)得NaCl的质量为23.4g
所以,根据方程式得m(NaOH)=(23.4/58.5)*40=16g
m[Ma(OH)2]=(23.4/58.5)/(2/58)=11.6g
反应前,所有物质的总质量为,不纯的氯化镁样品加上氢氧化钠溶液,把氢氧化钠溶液的质量设为x
反应后,由于在(1)中得MgCl2的质量为19g,所以不溶的杂质沉淀为1g,而反应又得到11.6g
Mg(OH)2沉淀,所以剩下的总质量为234g
那么建立方程式:(20+x)-(1+11.6)=234
解得x=231g,所以,加入氢氧化钠溶液中溶质的质量分数为:16g/231g*100%=7.1%
过程:MgCl2+2NaOH=Mg(OH)2+2NaCl
溶质为NaCl,它的质量分数为10%,所以NaCl的质量为234g*10%=23.4g
根据方程式,得m(MgCl2)=(23.4/58.5)/(2/95)=19g
(2)7.1%
过程:由(1)得NaCl的质量为23.4g
所以,根据方程式得m(NaOH)=(23.4/58.5)*40=16g
m[Ma(OH)2]=(23.4/58.5)/(2/58)=11.6g
反应前,所有物质的总质量为,不纯的氯化镁样品加上氢氧化钠溶液,把氢氧化钠溶液的质量设为x
反应后,由于在(1)中得MgCl2的质量为19g,所以不溶的杂质沉淀为1g,而反应又得到11.6g
Mg(OH)2沉淀,所以剩下的总质量为234g
那么建立方程式:(20+x)-(1+11.6)=234
解得x=231g,所以,加入氢氧化钠溶液中溶质的质量分数为:16g/231g*100%=7.1%
温馨提示:内容为网友见解,仅供参考
第1个回答 2020-05-07
氯化镁与氢氧化钠溶液生成氯化钠和氢氧化钠,得到的溶液就为氯化钠的溶液,其质量分数为10%,溶液质量为234克,则氯化钠的质量为23。4克,其物质的量为0。4mol。则氯离子和钠离子都有0。4mol。则氯化镁有0。2mol(MgCl2)所以氯化镁的质量为0。2×(24+35.5×2)=19克.
氯化钠的质量为23。4克,反应后的溶液质量为234克.,则水的质量为(234--23.4)=210.6克.氢氧化钠的物质的量为0。4mol,则其质量为(0.4×40)=16克.它的质量分数为16÷(210.6+16)×100%=7.1%.
氯化钠的质量为23。4克,反应后的溶液质量为234克.,则水的质量为(234--23.4)=210.6克.氢氧化钠的物质的量为0。4mol,则其质量为(0.4×40)=16克.它的质量分数为16÷(210.6+16)×100%=7.1%.
相似回答